Scale Out et Scale Up de votre production de thérapie cellulaire
Par le Dr Hue-Tran Hornig-Do.
Le domaine des thérapies cellulaires progresse rapidement et pose des défis majeurs à la fabrication pour répondre à une demande croissante. Une fabrication efficace est un aspect essentiel pour décider de commercialiser ou non une thérapie cellulaire. Cependant, l'extension du nombre de produits médicaux à base de cellules vivantes à une large population de patients n’est pas sans défis. Les cellules étant le produit thérapeutique, elles doivent conserver leur phénotype et leur fonctionnalité à chaque étape du processus, quelle que soit la méthode de fabrication.
Étendre et augmenter la production
Il existe deux stratégies largement utilisées pour générer un grand nombre de cellules : le “scale-up” ou le “scale-out”. Les systèmes “scale-up” sont basés sur l’utilisation de cuves plus grandes pour augmenter la capacité de production, tandis que les systèmes “scale-out” augmentent la capacité en utilisant plusieurs cuves de culture fonctionnant en parallèle.1,2 Les deux stratégies ont leurs avantages et leurs inconvénients et ne sont pas nécessairement mutuellement exclusives. Les protocoles complets incluent souvent les deux. Le processus “scale-out” peut être simple, car l’unité de production reste la même, mais la reproductibilité peut être difficile à atteindre. Cependant, le processus “scale-up” peut être plus complexe et nécessite plus de planification, mais il peut réduire les coûts du produit à long terme. La stratégie à utiliser dépend de la quantité nécessaire à la fabrication du médicament. Examinons cela de plus près en utilisant les thérapies cellulaires autologue et allogénique comme exemples.
Les thérapies cellulaires autologues sont des exemples de médecine personnalisée utilisant les cellules d’un patient comme point de départ et sont fabriquées en un seul lot par patient.3 Ici, le concept de “scale-out” peut être appliqué lorsque plusieurs lignes de production parallèles pour des produits de patients individuels sont configurées et exécutées simultanément dans la même installation de production. Une telle approche de fabrication “scale-out” peut également être transférée à d’autres installations de fabrication pour augmenter la production. Par exemple, ce modèle est actuellement adopté par les entreprises de biotechnologies des cellules chimériques du récepteur de l’antigène (CAR-)T grâce à la mise en place d’installations de fabrication régionales aux États-Unis et en Europe, ainsi qu’à l’expansion dans d’autres régions. Cependant, les thérapies allogéniques sont fabriquées en grandes quantités à partir de tissus de donneurs non apparentés et sont considérées comme un produit “standard” utilisé pour traiter de nombreux patients4. Ces thérapies nécessitent une approche “scale-up” en augmentant le volume des récipients de fabrication.
Plateforme adhérente ou de suspension
Quelle méthode “scale-up” est la meilleure pour mon approche ? Le choix d’une plateforme adhérente ou de suspension dépend essentiellement du type de cellule. Les plateformes de culture cellulaire essayent essentiellement d’imiter l’environnement natif du type de cellule cultivée. Par exemple, les cellules provenant de tissus solides, comme les muscles, sont plus adaptées à la culture adhérente. Alors que les cellules provenant de tissus liquides, comme le sang, sont plus appropriées à la culture en suspension. Les cellules CAR-T sont non adhérentes et peuvent être cultivées dans des systèmes de culture en suspension. Alors que les cellules souches existant principalement dans des niches dépendantes du contact direct avec d’autres cellules et matrices extracellulaires peuvent être développées avec succès à l’aide de plateformes adhérentes.
Un avantage clé des plateformes adhérentes est la capacité d’utiliser diverses modifications de surface qui imitent un microenvironnement local. Un autre avantage est le bénéfice de la visualisation directe dans certains systèmes adhérents : la croissance cellulaire dans des flacons ou des récipients empilés peut être facilement contrôlée au microscope. Les cultures adhérentes offrent également un gain de temps, un avantage significatif pour les start-up qui souhaitent se lancer rapidement sur le marché. Ces avantages font des systèmes de culture cellulaire adhérents un bon choix pour de nombreux programmes de thérapie cellulaire et génique, qui ont tendance à impliquer des types de cellules dépendantes de l’ancrage.
Cependant, le processus “scale-up” dans une plateforme de suspension a longtemps été considéré comme la méthode préférée. L’une des raisons en est que les cultures en suspension peuvent être cultivées dans des bioréacteurs à cuve agitée classiques à grande échelle, ce qui réduit les étapes de traitement et diminue l’empreinte de l’installation. Cependant, le processus “scale-up” sur des cellules cultivées en suspension dans des récipients plus grands présente également certains pièges et nécessite une agitation soigneuse pour assurer un échange adéquat de gaz et de nutriments, tout en minimisant les dommages cellulaires induits par le stress de cisaillement.5 Une évaluation approfondie de la dynamique des flux de culture basée sur les spécifications de l’équipement (par exemple, le nombre de roues, les vitesses d’agitation et les stratégies de mélange) est essentielle pour déterminer les effets potentiels sur les cellules. Malgré ces défis, les cultures en suspension offrent une évolutivité et peuvent produire le volume élevé de cellules nécessaires aux applications. Cette évolutivité et ce contrôle font des plateformes de suspension une option attrayante pour les fabricants qui cherchent à augmenter leur efficacité opérationnelle.
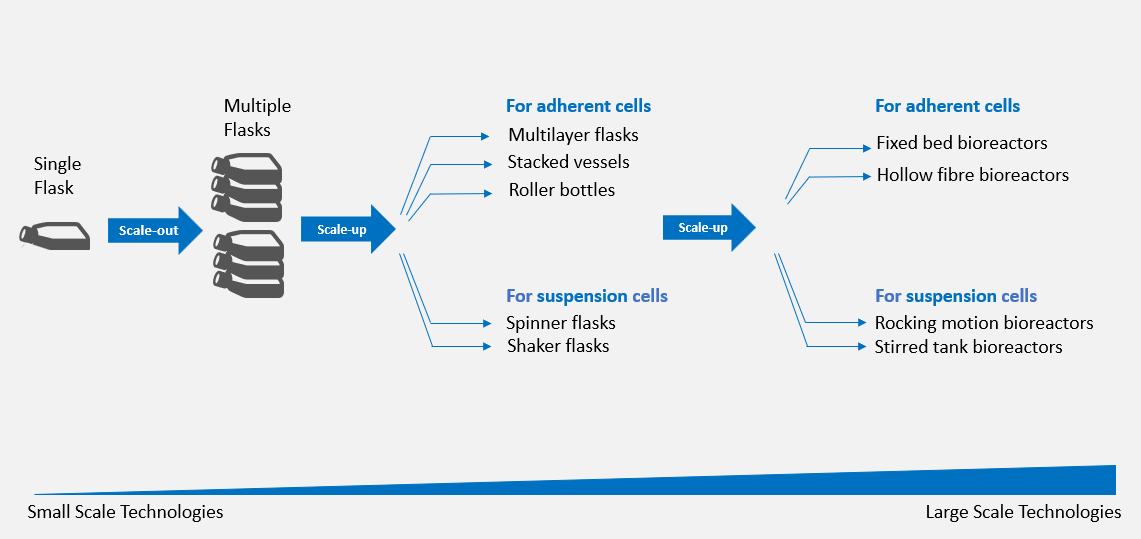
Figure 1 : Systèmes de mise à l’échelle des cultures de cellules adhérentes et de cellules en suspension
Est-il possible d’amener les cellules adhérentes à changer de modalités et à les rendre aptes aux conditions de culture en suspension ? Oui, c’est possible, et un exemple classique est la production d’anticorps monoclonaux à l’aide de cellules ovariennes de hamster chinois (CHO). Les chercheurs ont adapté ces cultures pour prospérer dans un environnement en suspension. Aujourd’hui, elles sont principalement produites de cette manière. Cependant, cela nécessite souvent une adaptation poussée et parfois une modification génétique des lignées cellulaires adhérentes pour les adapter aux conditions de culture en suspension. Cela prend du temps et représente plus de travail.
La question est de savoir si cet effort considérable en vaut la peine pour vos besoins. Toutes les approches n’ont pas besoin de ce type d’échelle. Les thérapies autologues et géniques ciblant des maladies rares ou de petites populations de patients peuvent être produites suffisamment à plus petite échelle. De plus, de grands progrès ont été réalisés dans le développement de plateformes de culture cellulaire adhérente menant à de nouvelles technologies telles que les microporteurs et les bioréacteurs à lit fixe qui permettent de réaliser des économies similaires avec la culture adhérente comme avec les méthodes de suspension. Examinons différents systèmes de culture cellulaire.
Systèmes de culture de la petite échelle à l’échelle industrielle
Les cellules sont cultivées dans des cultures à petite échelle comme dans un seul flacon en T qui peut être mis à l’échelle dans plusieurs flacons. Au stade de l’échelle de laboratoire, la transition vers des récipients plus grands peut être déployée pour un processus de scale up. Les flasques multicouches, ou empilées et les flacons à rouleaux sont les dispositifs les plus utilisés pour mettre à l’échelle la culture adhérente, tandis que les flacons spinner et les flacons d'agitation sont un choix approprié pour mettre à l’échelle les cellules en suspension à l’échelle du laboratoire.
Le cas échéant, le procédé passe à l’échelle industrielle. Les bioréacteurs à mouvement oscillant, les bioréacteurs à cuve agitée, les bioréacteurs à lit fixe et les bioréacteurs à fibres creuses font partie des quatre dispositifs les plus utilisés pour développer des cellules à l’échelle industrielle. Les bioréacteurs à mouvement oscillant et à cuve agitée sont largement utilisés pour l’expansion des cellules en suspension telles que les cellules T6. Alors que les bioréacteurs à support structuré, comme les bioréacteurs à lit fixe et à fibres creuses, ont été utilisés pour étendre les cellules adhérentes telles que les CSM et les CSH dérivées du cordon ombilical humain7,8.
Est-il possible de cultiver des cellules adhérentes dans un système de suspension ? Les microporteurs sont de petites sphères disponibles en différentes tailles, différents matériaux et revêtements qui permettent la croissance de cellules adhérentes dans un système de suspension. Ils peuvent être ajoutés aux flacons spinner principalement pour effectuer des tests préliminaires avant de passer à des bioréacteurs à cuve agitée plus grands pour générer un système hybride adhérent / suspension.9
En résumé, il n’y a pas de plateforme “taille unique”, différentes technologies offrent différents avantages qui ont des pondérations différentes pour vous en fonction de vos ressources, de votre échelle, de vos besoins de visualisation et d’automatisation. Il s’agit finalement d’établir vos besoins et vos attentes concernant votre plateforme.
Au sein de Fisher Scientific, nous sommes là pour vous aider à déterminer quelle solution peut le mieux répondre à vos objectifs. Notre but est d’aider les chercheurs et les fabricants à faire progresser les thérapies cellulaires innovantes en fournissant des produits et des outils fiables, y compris une large gamme de systèmes de culture innovants des principaux fabricants.
Références
1. Roh K-H, Nerem RM, Roy K. Biomanufacturing of therapeutic cells: state of the art, current challenges, and future perspectives. Ann Rev Chem Biomol Eng. (2016) 7:455–78.
2. Macdonald GJ. Scale-out plus single-use can multiply yields: single-use technology reduces some biomanufacturing equations to scale-out> scale-up. Genetic Eng Biotechnol News. (2019) 39:46–8.
3. Fesnak AD. The challenge of variability in chimeric antigen receptor T cell manufacturing. Regen Eng Transl Med. (2020) 6:322–9.
4. Caldwell KJ, Gottschalk S, Talleur AC. Allogeneic CAR Cell Therapy—More Than a Pipe Dream. Front. Immunol. (2021) 11:618427.
5. Eaker S, Abraham E, Allickson J, Brieva TA, Baksh D, Heathman TRJ et coll. Bioreactors for cell therapies: current status and future advances. Cytotherapy (2017) 19:9–18.
6. Smith TA. CAR-T cell expansion in a Xuri cell expansion system W25. Methods Mol Biol (2020) 2086:151–63. 7. Park S, Stephanopoulos G. Packed bed bioreactor with porous ceramic beads for animal cell culture. Biotechnol Bioeng. (1993) 41:25–34.
8. Gagliardi C, Khalil M, Foster AE. Streamlined production of genetically modified T cells with activation, transduction and expansion in closed-system G-Rex bioreactors. Cytotherapy (2019) 21:1246–57.
9. Bodiou V, Moutsatsou P, Post MJ. Microcarriers for upscaling cultured meat production. Front Nutr. (2020) 7:10.




22_04.jpg-650.jpg)