Savez-vous ce qu’est la PCR ?
Nous avons tous beaucoup entendu parler des tests PCR dernièrement, car cette technique d’analyse a été mise en avant en raison de son utilité dans le dépistage de la COVID-19. Ce terme, principalement réservé aux scientifiques, et plus particulièrement aux biologistes, est désormais dans toutes les bouches, comme si nous savions tous exactement de quoi il s’agit. Mais qu’est-ce que la PCR, au fait ? “PCR” est un acronyme anglais signifiant “Polymerase Chain Reaction” (réaction de polymérisation en chaîne ). Il désigne une technique de laboratoire utilisée pour créer rapidement des copies d’un segment d’ADN. Elle permet aux scientifiques de prélever un tout petit fragment de séquences d'ADN, puis de l’amplifier afin d’obtenir une quantité suffisante pour l’étudier en détail lors d’une étape ultérieure.
Pour le test COVID-19, la technique utilisée est la RT-PCR (Reverse Transcription Polymerase Chain Reaction) : des substances appelées transcriptase inverse ou ADN polymérase sont ajoutées à un échantillon nasopharyngé dans un laboratoire. Les coronavirus contiennent un génome à ARN non segmenté. La transcriptase inverse est nécessaire pour transcrire l'ARN viral en ADNc (ADN complémentaire). L'ADNc peut ensuite être utilisé comme matériel de départ dans une PCR pour amplifier des séquences spécifiques à l'aide d'une ADN polymérase. Des amorces et des sondes spécialement conçues se fixent aux séquences d'ADNc pour signaler qu'un agent pathogène a été découvert.
Cette technique est utilisée pour un diagnostic médical rapide de maladies telles que la COVID-19, mais aussi pour la tuberculose et d’autres infections. Elle est également courante dans les domaines de la recherche biomédicale et de la médecine légale. Il n’existe pas qu’une seule méthode PCR. Voici donc un tableau expliquant les principaux avantages et inconvénients de chaque méthode.
PCR en temps réel, PCR classique et PCR numérique en un clin d’œil
| PCR numérique | PCR en temps réel | PCR classique | |
|---|---|---|---|
| Présentation | Mesure la fraction de réplicats négatifs pour déterminer les copies absolues | Mesure l’amplification par PCR au fur et à mesure qu’elle se produit | Mesure la quantité de produits de PCR accumulés à la fin des cycles de PCR |
| Une analyse quantitative ? | Oui, la fraction de réactions de PCR négatives est adaptée à un algorithme statistique de la loi de Poisson | Oui, car les données sont recueillies au cours de la phase de croissance exponentielle (log) de PCR lorsque la quantité de produits de PCR est directement proportionnelle à la quantité d’acide nucléique de la matrice | Non, bien que comparer l’intensité de la bande amplifiée sur un gel avec des étalons d’une concentration connue puisse vous donner des résultats “semi-quantitatifs” |
| Applications |
|
| Amplification de l’ADN pour :
|
| Résumé | Avantages de la PCR numérique :
| Avantages de la PCR en temps réel :
| Inconvénients de la PCR classique :
|
Pour comprendre pourquoi la PCR classique est limitée, il est important de comprendre ce qui se passe lors d’une réaction de PCR. Une analyse PCR de base peut être divisée en trois phases :
- Exponentielle
Le produit est doublé à chaque cycle et s’accumule (en supposant que la réaction est efficace à 100 %). La réaction est très spécifique et précise. L’amplification exponentielle a lieu, car tous les réactifs sont frais et disponibles et la cinétique de la réaction pousse la réaction à favoriser le doublement de l’amplicon
- Linéaire (forte variabilité)
Au fur et à mesure que la réaction avance, certains réactifs sont consommés par suite de l’amplification. Les réactions commencent à ralentir et le produit de la PCR n’est plus doublé à chaque cycle.
- Plateau (point final : détection sur gel pour les méthodes classiques)
La réaction s’est arrêtée, aucun produit supplémentaire n’est généré et, si cette réaction est mise de côté pendant un certain temps, les produits de la PCR commencent à se dégrader. Chaque tube ou réaction s’immobilisera à un point différent, en raison de la cinétique de réaction différente pour chaque échantillon. Ces différences peuvent être observées dans la phase de plateau. Avec la PCR classique, les mesures sont prises au niveau de la phase de plateau, également appelée détection en point final.
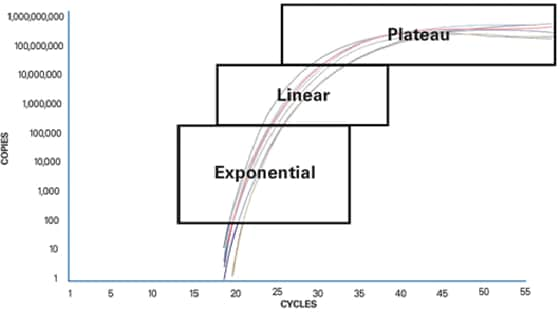
Figure 1 : phases de la PCR.
Mesures de PCR classiques à la phase de plateau, donnant des résultats variables
Dans la Figure 2, trois échantillons répliqués, qui avaient la même quantité d’ADN au début de la réaction, génèrent des quantités différentes de produits de PCR au niveau de la phase de plateau de la réaction (du fait des variations dans les cinétiques de réaction). Par conséquent, il est plus précis de prendre des mesures au cours de la phase exponentielle, où les échantillons répliqués s’amplifient de façon exponentielle.
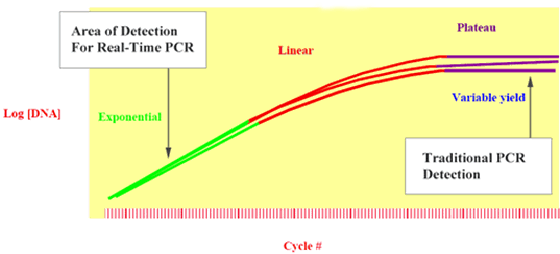
Figure 2 : des échantillons identiques génèrent des quantités différentes de produits de réaction au niveau de la phase de plateau de la PCR.
Mesures de PCR en temps réel à la phase exponentielle pour une évaluation quantitative plus précise
La PCR en temps réel se concentre sur la phase exponentielle, car cette phase fournit des données plus précises et exactes pour l’évaluation quantitative. Dans la phase exponentielle, l’instrument de PCR en temps réel calcule deux valeurs. La ligne de seuil correspond au niveau de détection auquel une réaction atteint une intensité fluorescente supérieure au bruit de fond. Le cycle de PCR où l’échantillon atteint ce niveau est appelé seuil de cycle (Cycle Threshold [Ct]). La valeur Ct est utilisée pour l’évaluation quantitative en aval ou pour la détection de la présence ou de l’absence. En comparant les valeurs Ct des échantillons dont la concentration est inconnue avec une série d’étalons, la quantité de matrices d’ADN dans une réaction inconnue peut être déterminée avec précision.
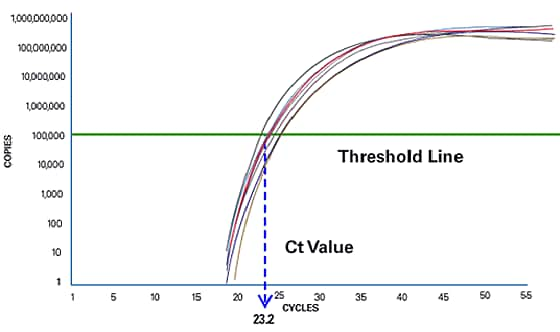
Figure 3 : le cycle de PCR où l’échantillon atteint une intensité fluorescente supérieure au bruit de fond est le seuil de cycle, ou Ct.
La PCR numérique permet d’obtenir le nombre de molécules individuelles pour l’évaluation quantitative absolue
La PCR numérique fonctionne en fractionnant un échantillon en de multiples réactions de PCR en temps réel. Certaines portions de ces réactions contiennent la molécule cible (positive), d’autres non (négative). Après une analyse de la PCR, la fraction de réponses négatives permet de générer une réponse absolue permettant d’obtenir le nombre exact de molécules cibles dans l’échantillon, sans avoir besoin de se référer à des étalons ou à des contrôles endogènes.
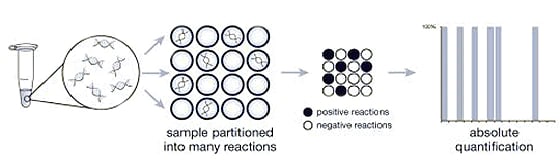
Figure 4 : la PCR numérique utilise le rapport entre les réactions PCR positives (noires) et les réactions PCR négatives (blanches) pour compter le nombre de molécules cibles.




