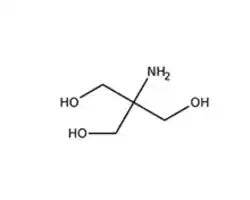
Gels d'électrophorèse à l'acrylamide
Les gels d'électrophorèse en acrylamide sont conçus pour l'électrophorèse des protéines et des acides nucléiques. Obtenez une séparation optimale de vos protéines cibles avec des gels disponibles en différents types, densités, tailles, configurations de puits et formulations de tampons, adaptés aux applications PAGE natives et dénaturantes.
Sélection rapide
Économisez maintenant - Offres exclusives sur le Web
Code produit 200062254
Code produit 7237806
Code produit 7164743
Code produit 7164745
Code produit 7164741
Code produit 7237810
Code produit 7237819
Code produit 7182048
Code produit 7237822
Code produit 7237803
Code produit 7237823
Code produit 7237813
Les Indispensables
Code produit 7237830
Code produit 7237821
Code produit 7237825
Code produit 200062271
Code produit 7237818
Code produit 7237831
Code produit 7224320
Code produit 7224325
Complétez votre commande
Code produit 11529166
Code produit 11549166
Code produit 10424012
Questions fréquemment posées
En électrophorèse sur gel, l'acrylamide est utilisé pour former un gel de polyacrylamide, qui sert de matrice à travers laquelle des molécules telles que des protéines ou des acides nucléiques peuvent être séparées en fonction de leur taille et de leur charge. Voici les rôles et fonctions clés de l'acrylamide en électrophorèse sur gel :
Formation du gel
L'acrylamide, en combinaison avec un agent de réticulation (généralement N,N'-méthylènebisacrylamide), subit une réaction de polymérisation pour former un gel de polyacrylamide. Ce gel consiste en un réseau de longues chaînes polymères réticulées entre elles, créant une structure poreuse.
Contrôle de la taille des pores
La concentration d'acrylamide et le ratio acrylamide/bisacrylamide déterminent la taille des pores du gel. Des concentrations plus élevées d'acrylamide créent des pores plus petits, ce qui permet une résolution plus élevée pour la séparation des petites molécules. Inversement, des concentrations plus faibles créent des pores plus grands, adaptés à la séparation des molécules plus grandes. Les concentrations typiques d'acrylamide varient de 3 à 20 %, les pourcentages plus faibles étant utilisés pour les molécules plus grandes et les pourcentages plus élevés pour les molécules plus petites.
Résolution et séparation
Le gel de polyacrylamide agit comme un tamis moléculaire. Les petites molécules se déplacent plus facilement à travers les pores et migrent donc plus rapidement, tandis que les grandes molécules sont freinées et migrent plus lentement. Cette migration dépendante de la taille permet la séparation des molécules en fonction de leur taille.
En électrophorèse des protéines, telle que la SDS-PAGE (électrophorèse sur gel de polyacrylamide en présence de dodécylsulfate de sodium), les protéines sont dénaturées et recouvertes de SDS, ce qui leur confère une charge négative uniforme.
L'électrophorèse sur gel d'agarose et l'électrophorèse sur gel d'acrylamide sont deux techniques courantes utilisées pour séparer les molécules, généralement les acides nucléiques et les protéines, en fonction de leur taille et de leur charge. Les principales différences entre les deux sont :
Composition du gel
- Électrophorèse sur gel d'agarose : Utilise de l'agarose, un polysaccharide extrait des algues marines. Le gel est coulé en dissolvant de la poudre d'agarose dans une solution tampon, puis en laissant refroidir et solidifier.
- Électrophorèse sur gel d'acrylamide : Utilise du polyacrylamide, formé par la polymérisation de monomères d'acrylamide avec un agent de réticulation (généralement le bisacrylamide). Le processus de polymérisation est initié chimiquement.
Taille des pores
- Agarose : A des pores relativement grands, ce qui le rend adapté à la séparation de molécules plus grandes telles que les fragments d'ADN (généralement de 100 pb à plusieurs kb).
- Acrylamide : A des pores plus petits et plus uniformes, adaptés à la séparation de molécules plus petites telles que les protéines et les petits acides nucléiques (généralement de 5 pb à 1 kb).
Résolution
- Agarose : Offre une résolution plus faible en raison de la taille plus grande des pores, idéale pour séparer les grands fragments d'ADN mais moins efficace pour les petits fragments ou les protéines.
- Acrylamide : Offre une résolution plus élevée en raison de la taille plus petite des pores, ce qui le rend idéal pour distinguer les protéines ou les petits fragments d'acides nucléiques avec de petites différences de taille.
Applications
- Agarose : Utilisé couramment pour l'électrophorèse de l'ADN et de l'ARN, en particulier pour les analyses de routine telles que la vérification de la taille des produits PCR, les digestions de restriction et l'intégrité de l'ARN.
- Acrylamide : Utilisé couramment pour l'électrophorèse des protéines (SDS-PAGE) et les gels de séquençage de l'ADN à haute résolution, ainsi que pour la séparation des petits fragments d'acides nucléiques.
Préparation et manipulation
- Agarose : Plus facile et plus sûr à préparer, car il n'implique pas de produits chimiques toxiques. Il suffit de dissoudre dans un tampon, de chauffer et de verser dans un moule.
- Acrylamide : Plus complexe et nécessite une manipulation soigneuse en raison de la toxicité des monomères d'acrylamide. La polymérisation doit être soigneusement contrôlée, généralement avec l'ajout de TEMED et de persulfate d'ammonium.
Tampon de course
- Agarose : Utilise souvent des tampons TAE (Tris-acétate-EDTA) ou TBE (Tris-borate-EDTA).
- Acrylamide : Utilise typiquement un tampon Tris-Glycine-SDS pour l'électrophorèse des protéines (SDS-PAGE).
Lors de la sélection de gels d'électrophorèse en acrylamide, plusieurs facteurs importants doivent être pris en compte pour garantir une séparation et une analyse optimales de vos échantillons. Voici cinq considérations clés :
Concentration d'acrylamide : La concentration d'acrylamide dans le gel détermine la taille des pores, ce qui affecte directement la résolution et la gamme de tailles de molécules pouvant être séparées. Les concentrations plus faibles (par exemple, 5-8 %) sont utilisées pour les protéines ou les acides nucléiques plus grands, tandis que les concentrations plus élevées (par exemple, 10-20 %) sont utilisées pour les protéines ou les acides nucléiques plus petits. Les gels à gradient, qui ont des concentrations d'acrylamide variables, peuvent être utilisés pour séparer une large gamme de tailles de molécules dans un seul gel.
Type de gel (dénaturant vs. natif) : Les gels dénaturants sont utilisés pour séparer les molécules uniquement en fonction de leur taille, avec l'utilisation d'agents dénaturants comme le SDS (SDS-PAGE pour les protéines) ou l'urée (pour les acides nucléiques). Ces gels perturbent les structures secondaires et tertiaires, donnant aux molécules un rapport charge/masse uniforme. Les gels natifs sont utilisés pour séparer les molécules en fonction de leur conformation native, de leur charge et de leur taille. Ces gels ne contiennent pas d'agents dénaturants, préservant la structure et la fonction naturelles des molécules.
Système tampon : Le choix du tampon peut influencer la résolution, les conditions de course et les types de molécules mieux séparées par le gel. Les systèmes tampons courants incluent le Tris-Glycine pour la SDS-PAGE et le Tris-Borate-EDTA (TBE) ou le Tris-Acetate-EDTA (TAE) pour les acides nucléiques. Assurez-vous que le système tampon est compatible avec le type d'électrophorèse effectué et les molécules analysées.
Épaisseur et format du gel : L'épaisseur du gel peut affecter la résolution et la quantité d'échantillon pouvant être chargée. Les gels plus épais peuvent accueillir des volumes d'échantillon plus importants mais peuvent nécessiter des temps de course plus longs. Le format du gel (par exemple, gels en plaques, gels à gradient ou gels en tubes) doit être sélectionné en fonction de l'application spécifique et de l'équipement disponible.
Polymérisation et préparation du gel : Considérez le processus de polymérisation et la manipulation de l'acrylamide, qui est un neurotoxine sous forme monomérique. Assurez-vous que les protocoles de sécurité appropriés sont suivis lors de la préparation du gel. Les conditions de polymérisation (par exemple, la concentration de TEMED et de persulfate d'ammonium) doivent être optimisées pour produire une matrice de gel uniforme et cohérente.
En prenant en compte ces facteurs, vous pouvez sélectionner les gels d'électrophorèse en acrylamide les plus appropriés pour vos besoins de recherche spécifiques, garantissant des résultats fiables et reproductibles.